A preferência de hospedeiros como mosquitos, embora tenha uma base genética, é caracterizada pela alta plasticidade mediada pela densidade de espécies hospedeiras, que por sua abundância formam uma fonte de sangue prontamente acessível. O comportamento de seleção de hospedeiros em mosquitos é uma exceção e não a regra.
Maringá – PR – 22 de Abril de 2022.
3 Minutos
Os vetores são organismos que podem transmitir agentes etiológicos – parasitas, causadores de doenças infecciosas entre os seres humanos, de animais para humanos, ou entre os animais. Muitos destes vetores são insetos hematófagos (organismos que se alimentam de sangue), e dessa forma, ingerem microrganismos, causadores de doenças, durante um repasto sanguíneo em um hospedeiro infectado humano ou animal e, posteriormente, os transmitem para um novo hospedeiro durante a sua subsequente alimentação.
Dentre esses insetos destaca-se as moscas tsé-tsé (Fig. 1) pois são diferentes de muitas outras moscas porque se alimentam exclusivamente de sangue de vertebrados e se reproduzem por viviparidade adenotrófica (após a eclosão, as larvas são retidas no corpo da mãe). Sua taxa reprodutiva lenta sugere que os protocolos de controle de insetos devem ser mais bem-sucedidos do que em outros sistemas. Este não foi o caso, pois a maioria dos programas de controle da mosca tsé-tsé falharam a longo prazo. Mais de 70 milhões de pessoas estão em risco de tripanossomíase humana africana (HAT) em 36 países.Estima – se que Nagana, tripanossomíase animal (AAT), custa à agricultura africana US$ 4,5 bilhões por ano por meio da perda de alimentos, esterco e poder de tração.

A maioria das populações de mosca tsé-tsé ocorre nas latitudes de 12°N a 25°S, cerca de um terço do continente africano (Figura 2). Para simplificar, a disponibilidade de umidade é limitante ao norte (Saara) e as baixas temperaturas limitam a distribuição ao sul. Assim, as moscas tsé-tsé estão amplamente confinadas à África subsaariana, embora populações de Glossina pallidipes e G. palpalis tenham sido registradas no canto sudoeste da Península Arábica. Eles são prováveis sobreviventes de épocas anteriores, quando prevaleciam climas mais equilibrados.
Seria interessante examinar suas afinidades genéticas. Mapas de distribuição de 30 táxons tsé-tsé estão disponíveis e correlações de distribuição com índices de imagens de satélite confirmam que cada um tem requisitos específicos de temperatura e precipitação.
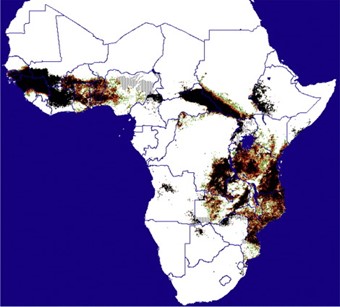
Fonte: ERGO Ltd e TALA, Oxford.
As moscas tsé-tsé são os únicos vetores das espécies de Trypanosoma brucei. Ambas as subespécies diferem em relação à ocorrência geográfica, subespécies de moscas tsé-tsé, ao ambiente em que esses vetores podem abundar e, em particular, em relação às suas manifestações clínicas e ao curso temporal da doença. T. gambiense (tripanossomíase da África Ocidental) seguem um curso crônico, a meningoencefalite crônica se desenvolve frequentemente apenas muitos meses, ou mesmo anos, após a inoculação do agente patogênico, enquanto o T. rhodesiense (tripanossomíase da África Oriental) apresenta regularmente um curso subagudo, e a meningoencefalite subaguda/crônica pode se desenvolver dentro de alguns meses após a exposição.
Picada Fatal
O cancro tripanossômico se desenvolve no local da inoculação (picada da mosca tsé-tsé), e em poucas semanas os tripanossomas se espalham para o sistema hemolinfático, levando ao primeiro estágio da tripanossomíase africana; além da febre, a linfadenopatia é a marca registrada desse estágio da doença. Gradualmente, os tripanossomas penetram e se multiplicam no LCR, vasos sanguíneos cerebrais e tecido cerebral. A variação antigênica tripanossômica, resultando em desafio antigênico contínuo, leva à secreção repetida de uma grande quantidade de IgM no sangue e no líquido cefalorraquidiano. Histologicamente as meningese o parênquima cerebral pericapilar apresenta infiltração linfocítica e plasmacelular (Kennedy, 2006; Brun et al., 2010).
O curso clínico posterior da tripanossomíase africana finalmente evolui – no segundo estágio – para um início insidioso de uma meningoencefalite subaguda (T. rhodesiens) ou crônica (T. gambiense). As características neurológicas correspondem a uma encefalopatia difusa, desregulação dos ciclos sono-vigília (“doença do sono”), sinais localizados, desregulação do sistema nervoso vegetativo, comprometimento da consciência (“doença do sono”) e, finalmente e invariavelmente, morte.
A demonstração dos parasitas microscopicamente em esfregaço de sangue, glândula linfática ou aspirado de cancro tripanossômico no primeiro estágio da doença pode ser aprimorada por técnicas de concentração, centrifugação de microhematócritos e técnicas quantitativas modificadas de revestimento inchado. Como o início do estágio meningoencefalítico é muito insidioso, todos os pacientes com tripanossomíase africana de primeiro estágio precisam de exame imediato do LCR. Quaisquer achados patológicos no LCR devem ser interpretados como a presença do segundo estágio da doença. O exame do LCR geralmente mostra um número aumentado de linfócitos, células de mórula (= plasmócitos) e níveis de IgM altamente aumentados.
Tripanossomas móveis podem ser vistos em alta ampliação em preparações frescas do LCR (centrifugação aumenta a probabilidade de detecção). Os tripanossomas também podem ser vistos no esfregaço de sangue e/ou no fluido linfático. A inoculação de sangue, linfa ou fluído tecidual ou LCR em ratos ou camundongos de laboratório é um método confiável para aumentar o T. brucei rhodesiense, mas não é muito confiável na suspeita de diagnóstico de T. gambiense. O diagnóstico clínico pode ser apoiado por testes imunológicos, por exemplo, testes de fixação do complemento, ELISA, ELISA de captura de antígeno, IFAT e testes de aglutinação, por exemplo, teste de aglutinação em cartão – CATT ou CIATT, respectivamente.
Durante décadas, o tratamento das duas formas de tripanossomíase africana permaneceu praticamente inalterado. Um pilar absoluto da tripanossomíase africana de segundo estágio é que os pacientes precisam de agentes terapêuticos que sejam ativos contra o primeiro e o segundo estágio. Independentemente do estágio, o agente quimioterápico tripanocida para T. gambiense é eflornitina. Em áreas onde este medicamento não está disponível, a pentamidina pode ser usada. Na tripanossomíase da África Oriental (T. rhodesiense) a eflornitina tem pouco ou nenhum efeito, portanto, uma abordagem terapêutica em dois estágios (Suramin para o primeiro estágio seguido de Melarsoprol para o segundo estágio) é absolutamente necessária.
Um grande desafio e desvantagem no tratamento da doença do sono africana são os efeitos colaterais potencialmente fatais dos agentes quimioterápicos tripanocidas. Enquanto os efeitos colaterais da pentamidina, suramina e eflornitina geralmente não são fatais, taxas de mortalidade de 5% foram relatadas devido aos graves efeitos adversos do melarsoprol. Pacientes com tripanossomas demonstráveis no LCR apresentam risco aumentado de encefalopatia induzida por melarsoprol, que geralmente é observada dentro de 2 semanas após o início do tratamento.
Prednisolona concomitante a terapia pode prevenir a encefalopatia por arsênico, que se manifesta por comprometimento da consciência, febre e convulsões. No entanto, pode ser difícil discriminar a encefalite tripanossômica em andamento, em deterioração ou até mesmo em desenvolvimento recente da encefalopatia arsênico. Ambos os sintomas da doença podem levar ao aumento da pressão intracraniana e, portanto, a punção lombar em caso de deterioração neurológica é desencorajada. Assim, pode não ser possível discriminar essas duas entidades de doença por meio da deterioração do LCR. O tratamento do aumento da pressão intracraniana é obrigatório na encefalopatia arsênico; os pacientes recebem um bolus (administração de uma medicação) intravenoso de manitol, corticosteróides e, em caso de convulsões, diazepam ou fenobarbital. Insuficiência cardíaca ou arritmia cardíaca podem complicar o curso do tratamento. Uma vez que a maioria dos pacientes tratados com arsênico desenvolve diarreia grave, eletrólitos desarranjados podem complicar o quadro clínico da encefalopatia arsênico e seu tratamento. O prognóstico ainda pouco conhecido da doença do sono, torna a profilaxia ou mesmo a eliminação urgentemente necessária.
Características dos organismos e seus antígenos
Os tripanossomas transmitidos pela mosca tsé-tsé causam a doença do sono em humanos e uma doença relacionada, nagana, em animais domésticos na África. Esses parasitas protozoários flagelados se multiplicam amplamente no sangue do hospedeiro mamífero, mas podem invadir sítios extravasculares (linfáticos, tecido conjuntivo, sistema nervoso central), dependendo da espécie de tripanossoma.
Dois tipos de doença do sono são reconhecidos: uma forma crônica da África Ocidental transmitida por tsé-tsé ribeirinho e causada por Trypanosoma brucei gambiense, e uma forma aguda da África Oriental transmitida por moscas da savana e causada pelo T. brucei rhodesiense morfologicamente idêntico. Uma terceira ‘subespécie’, T. brucei brucei, não pode infectar humanos, mas causa nagana em animais. Outras espécies de Trypanosoma, T. congolense e T. vivax, também causam nagana. Todas as três espécies passam por um complicado ciclo de desenvolvimento da mosca tsé-tsé (vetor) sugadora de sangue, detalhes que diferem com a espécie. Em todos os casos, o resultado final é a descarga do estágio metacíclico infectante de mamíferos com a saliva quando a mosca se alimenta de sangue.
A doença do sono é geralmente fatal, a menos que seja tratada com drogas tóxicas (por exemplo, suramina) e mais de 50 milhões de pessoas correm o risco de adquirir infecção. A tripanossomíase bovina é disseminada e tem efeitos devastadores na pecuária, impedindo a criação satisfatória de rebanhos a mais de 10 milhões de km2 ao sul do Saara. Antílopes e outros animais de caça servem como reservatórios de tripanossomíase humana e animal, muitas vezes não apresentando sintomas de doença. Fora do cinturão tsé-tsé da África, T. brucei (T. evansi) e T. vivax podem ser disseminados por tabanídeos e Stomoxys moscas agindo como “seringas voadoras”, transferindo a infecção diretamente de um hospedeiro para outro. As principais vítimas dessa transmissão mecânica são os animais de tração da agricultura e transporte não mecanizados no norte da África, América do Sul e sul da Ásia – cavalos e camelos em particular.
Vetores Mortais – Mosca Tsé-Tsé, a mosca assassina
Como a quimioprofilaxia provou ser insatisfatória e o controle de vetores levanta grandes problemas ambientais, a vacinação tem sido considerada uma solução potencialmente ideal para o problema da tripanossomíase africana. Infelizmente é um ideal inatingível, pois embora o antígeno induzindo uma resposta humoral protetora seja bem caracterizado como uma glicoproteína de superfície cobrindo todo o tripanossoma, o parasita tem a capacidade de alterar repetidamente a natureza antigênica dessa glicoproteína (a variante glicoproteína de superfície, VSG) e assim evitar a destruição pela resposta imune do hospedeiro através da variação antigênica.
A base molecular da variação antigênica do tripanossoma tem recebido muita atenção nos últimos 30 anos, de modo que agora sabemos mais sobre o tripanossoma como desafio antigênico do que sobre a resposta do hospedeiro natural à infecção pelo parasita. A maior parte do nosso conhecimento sobre imunidade à tripanossomíase é baseado em infecções experimentais em roedores. Os tripanossomas africanos geralmente infectam animais de laboratório prontamente, mas a passagem repetida da seringa resulta em aumento da virulência do parasita com grande número de tripanossomas no sangue, enquanto em pacientes com doença do sono e bovinos ou animais de caça infectados, a parasitemia pode ser indetectável pelo exame microscópico do sangue.
O parasitismo é um dos modos de vida mais bem-sucedidos, medido pela frequência evolutiva e por quantas espécies parasitárias existem atualmente. O estudo da diversidade de espécies parasitárias é particularmente relevante, pois a especiação simpátrica pode ser importante em alguns táxons de organismos parasitas.
A complexidade da relação Parasita-Hospedeiro, nem sempre é clara e gera mal-entendidos sobre a natureza precisa do parasitismo. Podemos definir o parasitismo como uma relação simbiótica entre dois organismos, onde geralmente o menor dos dois, o parasita, é fisiologicamente dependente. A relação pode ser permanente, como no caso de nematódeos presentes no trato intestinal de vertebrados, ou temporárias como acontece com mosquitos fêmeas e carrapatos, que se alimentam intermitentemente do sangue do hospedeiro.
Quando existe dependência fisiológica, definimos o parasita como parasitas obrigatórios, basicamente por não serem capazes de sobreviver sem os recursos oferecidos pelo hospedeiro, como os vírus, frequentemente associados a problemas de saúde pública, por infectar humanos e animais de criação/domésticos. Por outro lado, os parasitas facultativos, são essencialmente de vida livre, sendo capazes de se tornar parasitários se colocados em uma situação propícia a esse modo.
Um exemplo de parasita facultativo é Naegleria fowleri (Carter, 1970), uma ameba de vida livre que pode ser encontrada na água ou solo, e pode infectar seres humanos e que pode resultar na patologia conhecida como meningoencefalite. Entretanto, a maioria dos parasitas necessitam de um hospedeiro e ou/vetor em seus ciclos de vida para ter sucesso na sobrevivência.
Problemas de um só mundo
Com a modernidade, a globalização e as mudanças provenientes das alterações climáticas rapidamente modificaram as relações entre os parasitos e as populações humanas, e proporcionaram grande impacto (não necessariamente negativo) sobre esses patógenos, ao mudar seus padrões ecoepidemiológicos devido às alterações dos parâmetros bióticos e abióticos. O aumento do tráfego de pessoas proveniente de viagens, comércio ou até eventos migratórios resultantes de conflitos possibilitaram o surgimento de novas rotas para os patógenos com consequente aumento na distribuição de algumas doenças. Estima-se que atualmente mais de 200 milhões de pessoas residem fora de seu local de origem. Toda interação entre espécies deve ocorrer dentro de um contexto ecológico e evolutivo.
Portanto, o hospedeiro constitui um ambiente no qual a parasita demanda parte ou toda a sua vida. Além disso, o habitat em que hospedeiro e parasita coexistem pode interferir na natureza e intensidade da interação hospedeiro-parasita, e o biótopo influenciará a probabilidade e a taxa de transmissão de parasitas direta ou indiretamente por meio de algum vetor parasita (Poulin; Morand, 2000). Os casos de doenças veiculadas por artrópodes aumentaram, principalmente em países emergentes e a compreensão do potencial de transmissão em paisagens urbanas requer a integração de processos sociológicos e ecológicos que regulam a dinâmica populacional do vetor, o comportamento alimentar e as interações vetor patógeno nesses ecossistemas únicos.
Um modelo interessante de transmissão é a dinâmica vetorial de Trypanosoma cruzi, que por sua vez é influenciada por fatores ambientais e sociais. A transmissão vetorial de T. cruzi sob o ponto de vista epidemiológico é considerada a mais interessante do ponto de vista epidemiológico, devido à sua conexão direta aos aspectos sociais, culturais e econômicos de uma população. A distribuição da doença de Chagas e seus vetores também oferecem modelos interessantes para estudos ecoepidemiológicos. Por muitas décadas, a doença de Chagas foi uma doença estritamente rural, que predominou apenas em zonas específicas de países neotropicais (Américas do Sul, Central e porção sul da América do Norte).
As doenças transmitidas por vetores representam mais de 17% de todas as doenças infecciosas, causando mais de 700.000 mortes anualmente (WHO, 2020). Essas doenças podem ter por agentes etiológicos organismos parasitas (protozoários, helmintos, fungos, bactérias e vírus). Por exemplo, o vírus da dengue é a infecção viral mais prevalente transmitida por Culicidae do gênero Aedes. Mais de 3,9 bilhões de pessoas em mais de 129 países correm o risco de contrair dengue, com um número estimado de 96 milhões de casos sintomáticos e um número estimado de 40.000 mortes por ano (WHO, 2020).
Os vetores são organismos que possuem a capacidade de transmitir patógenos infecciosos entre seres humanos ou de animais para seres humanos. Muitos desses vetores são insetos sugadores de sangue (e.g. dípteros dos gêneros Anopheles e Aedes ou hemípteros (barbeiros) do gênero Triatoma), que no repasto infectam-se com patógenos determinam a replicação dos mesmos e na sequência os transmitem para um novo hospedeiro, após a replicação do patógeno. No Brasil temos uma variedade de vetores que merecem atenção epidemiológica.

Os aspectos gerais das doenças parasitarias e infecciosas permeiam discussões que emergem da biologia e se entrelaçam com o desenvolvimento geopolítico, econômico, epistemológico, social e histórico. Elas são causadas por uma variedade de patógenos, como vírus, bactérias, fungos, protozoários e helmintos parasitas. Esse grupo diversificado de doenças transmissíveis que prevalecem em condições tropicais e subtropicais em 149 países – afetam mais de um bilhão de pessoas e custam bilhões de dólares às economias em desenvolvimento todos os anos (WHO, 2020). Além disso, atribui-se também como estigma social, danos à saúde mental, gênero (mulheres e crianças, atingidas em maior proporção), assiduidade escolar, morbidade e percas laborais.
Em 2008, a Organização Mundial de Saúde (OMS), a Organização das Nações Unidas para a Agricultura e Alimentação (FAO) e a Organização Mundial de Saúde Animal (OIE) concretizaram a iniciativa “Um Mundo, Uma Saúde”. O termo One health é um conceito que surgiu para mostrar a indissociabilidade da saúde humana, animal e ambiental. Essa abordagem enfatiza ainda os grandes desafios relacionados à saúde e alimentação na humanidade moderna, que exigem uma ação integralista dos três aspectos que norteiam a existência do homem.
Estimativas mostram que aproximadamente 60% das doenças infeciosas humanas são antropozoonoses; 75% dos agentes de doenças infeciosas no homem são de origem animal; cinco doenças novas no homem surgem por ano, sendo três de origem animal; 80% dos agentes causadores de doenças que podem ser utilizados como armas biológicas são zoonóticos (WHO, 2015). Portanto o monitoramento, a profilaxia das doenças infecciosas e parasitárias exigem investimento monetário para a contratação, manutenção de recursos humanos e aquisições laboratoriais para o desenvolvimento de pesquisas, assim como de ações educativas.
As informações sobre a frequência de algumas doenças infecciosas são de baixa qualidade ou insuficientes. Atualmente, é difícil resumir todas as informações sobre essas doenças, além disso o conhecimento produzido nem sempre reverte em avanços terapêuticos, como, por exemplo, novos fármacos, métodos diagnósticos e vacinas, bem como a percepção do público geral das benesses oferecidas pela ciência moderna, como o caso atual de descrença e desconfiança da ciência.
Um claro exemplo amplamente discutido na atualidade é a repulsa às vacinas, que no momento repercute nos órgãos de vigilância, pois parte da população influenciada por percepções religiosas, anacrônicas, sociais ou pessoais, tornam possível a volta de doenças infecciosas consideradas “extintas”, como o sarampo nos Estados Unidos e Brasil.
Eliane da Silva Fernandes – Doutora em Ciências Ambientais pela Un. Est. de Maringá (UEM). Especializada em Direito Ambiental.
Atua na área de Sistemas de Informação em Biodiversidade (Meta-análise), Políticas Ambientais, Macroecologia e
Avaliação de Impactos Ambientais em rios neotropicais.
Fontes:
Poulin, R.; Morand, S. The diversity of parasites. Quarterly Review of Biology University of Chicago Press, v.75, n.3, p.277-293, 2000.
WHO – World Health Organization. Especialistas debatem sobre o conceito “Saúde Única” para reforçar a integração das vertentes humana, animal e ambiental na Saúde Pública. OMS em Africa. 2015.
WHO – World Health Organization. WHO, 2020.
Agência Fiocruz de Notícias
World Neglected Tropical Diseases





















[…] “Estamos sob o risco do desconhecido e novas epidemias podem surgir, pois não sabemos qual a atual m…”, afirma Oliveira. Ainda, por acometerem a população economicamente ativa, as doenças tropicais negligenciadas retiram esses indivíduos de suas funções produtivas em sociedade. Além dos problemas individuais de saúde, pode-se considerar que as DTNs oneram o Estado, uma vez que anualmente milhares de pessoas necessitam de internações, medicamentos e de apoio social em afastamentos temporários ou permanentes, em decorrência da doença. Dessa forma, é mais efetivo e menos danoso para o indivíduo e para sociedade investir em prevenção. […]